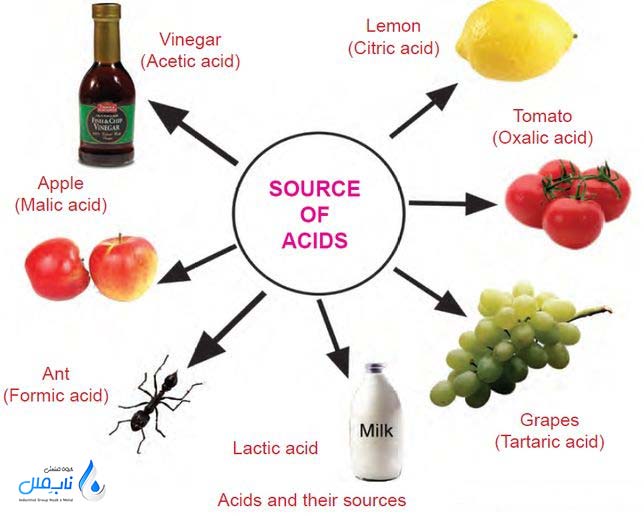
اسیدها ترکیباتی شیمیایی هستند که وقتی در آب حل می شوند، یونهای هیدروژن (+H) آزاد می کنند. به زبان ساده، اسیدها موادی هستند که طعم ترش دارند، می توانند برخی مواد را حل کنند و در واکنشهای شیمیایی نقش دهنده پروتون یا پذیرنده الکترون باشند. تعریف علمی اسید از دیدگاه دانشمندان:
- آرنیوس: اسید ماده ای است که در آب حل شده و +H (یون هیدروژن یا پروتون) آزاد می کند.
- برونستد-لوری: اسید ماده ای است که پروتون (+H) اهدا می کند.
- لوییس: اسید ماده ای است که جفت الکترون دریافت می کند.
خصوصیات کلی اسیدها
- طعم ترش: اکثر اسیدها طعم ترش دارند (مانند لیمو یا سرکه).
- رنگ نشانگرها را تغییر می دهند: کاغذ لیتموس را از آبی به قرمز تبدیل می کنند. با برخی مواد مانند فنل فتالئین یا متیل نارنجی واکنش نشان می دهند.
- خورنده بودن: بسیاری از اسیدها (مخصوصاً اسیدهای قوی) می توانند فلزات و مواد آلی را تجزیه کنند.
- واکنش با فلزات: اسیدها با برخی فلزات (مانند آهن یا روی) واکنش داده و گاز هیدروژن آزاد می کنند.
- واکنش با بازها: اسیدها با بازها واکنش داده و نمک و آب تشکیل می دهند. این واکنش خنثی سازی نامیده می شود.
- رسانایی الکتریکی: محلول های آبی اسیدها به دلیل یون های آزاد شده (مانند +H و Cl–) رسانای الکتریسیته هستند.
- pH کمتر از 7: محلول های اسیدی دارای pH کمتر از 7 هستند. هر چه مقدار pH کمتر باشد، اسید قوی تر است.
این خصوصیات به ما کمک می کند تا اسیدها را در کاربردهای روزمره و صنعتی شناسایی کرده و از آن ها استفاده کنیم.
مزایای اسیدها
اسیدها ترکیباتی با ویژگی های منحصر به فرد هستند که مزایای متعددی دارند. این مزایا شامل ویژگی های شیمیایی، فیزیکی و تأثیر آنها بر واکنش های مختلف است که در ادامه به مهمترین آنها اشاره خواهیم نمود:
- واکنش پذیری بالا: اسیدها در واکنش های شیمیایی به سرعت شرکت می کنند و باعث تسریع فرآیندهای شیمیایی می شوند.
- قدرت انحلال بالا: بسیاری از مواد، از جمله فلزات، نمکها و ترکیبات آلی، در اسیدها حل می شوند.
- توانایی تنظیم pH: اسیدها می توانند محیطهای شیمیایی را اسیدی کرده و نقش مهمی در حفظ تعادل اسیدی-بازی داشته باشند.
- قابلیت ایجاد پیوندهای یونی و مولکولی: اسیدها می توانند با ترکیبات مختلف واکنش داده و پیوندهای جدیدی ایجاد کنند.
- تأثیر بر تغییر ساختار مواد: اسیدها میتوانند ساختار فیزیکی و شیمیایی مواد را تغییر دهند و باعث تجزیه یا تغییر خواص آنها شوند.
- خاصیت خورندگی: برخی اسیدها قابلیت تجزیه و حل کردن سطوح و لایههای مختلف مواد را دارند.
- قابلیت تولید گازها: اسیدها در واکنش با برخی مواد، گازهای مختلفی تولید می کنند که می تواند در فرآیندهای شیمیایی تأثیرگذار باشد.
- پایداری و قابلیت کنترل: شدت و سرعت واکنش اسیدها را می توان تحت شرایط خاص کنترل و تنظیم کرد.
- نقش در فرآیندهای الکتروشیمیایی: اسیدها در انتقال یون ها و فرآیندهای مربوط به جریان الکتریکی در محلول ها مؤثر هستند.
- کاهش مقاومت برخی مواد: برخی مواد در حضور اسیدها خاصیت شکنندگی یا تغییرپذیری بیشتری پیدا می کنند.
- کاتالیز واکنش های شیمیایی: اسیدها می توانند به عنوان کاتالیزور عمل کرده و سرعت واکنشهای شیمیایی را افزایش دهند.
- توانایی تشکیل کمپلکس های شیمیایی: برخی اسیدها قادر به تشکیل ترکیبات کمپلکس با فلزات و سایر مواد هستند.
- خواص ضد عفونی کنندگی: بسیاری از اسیدها قادر به از بین بردن میکروبها و میکروارگانیسم های مضر هستند.
- امکان کنترل ویژگی های فیزیکی محلول ها: اسیدها بر چگالی، ویسکوزیته و سایر ویژگیهای فیزیکی محلول ها تأثیر می گذارند.
- قابلیت استفاده در شرایط دمایی و فشاری مختلف: اسیدها در دماها و فشارهای مختلف پایداری داشته و واکنش های متنوعی را تسهیل می کنند.
- توانایی جداسازی برخی عناصر و ترکیبات: اسیدها می توانند برخی عناصر را از ترکیبات پیچیده جدا کنند.
- قابلیت ترکیب با بازها برای تشکیل نمک ها: اسیدها با بازها واکنش داده و نمک ها را تشکیل می دهند که ویژگی های متفاوتی نسبت به مواد اولیه دارند.
کاربردهای اسیدها
اسیدها از مهم ترین ترکیبات شیمیایی هستند که در فرآیندهای طبیعی، صنعتی و زندگی روزمره کاربردهای گسترده ای دارند. اسیدها جزء لاینفک زندگی روزمره و فرآیندهای صنعتی هستند. از تولید محصولات غذایی و دارویی گرفته تا نقش آن ها در چرخه های طبیعی و تنظیم محیط زیست، اهمیت اسیدها در زندگی انسان غیرقابل انکار است. با این حال، استفاده نادرست از آنها می تواند مشکلاتی نظیر آلودگی محیط زیست و آسیب های سلامتی ایجاد کند. بنابراین استفاده هوشمندانه از اسیدها ضروری است. در زیر به برخی از نقش های آن ها اشاره شده است:
کاربردها در شیمی و صنایع
- تولید مواد شیمیایی: اسیدها به عنوان مواد اولیه برای تولید بسیاری از ترکیبات شیمیایی استفاده می شوند.
- مثال: تولید کودهای شیمیایی مانند آمونیوم سولفات با استفاده از اسید سولفوریک. تولید پلاستیک ها و رزین ها با اسید استیک.
- کاتالیزور در واکنش های شیمیایی: اسیدها اغلب به عنوان کاتالیزور در واکنش های شیمیایی استفاده می شوند.
- مثال: تولید اترها و استرها در حضور اسیدها.
- تصفیه فلزات: اسیدها در حذف زنگ زدگی و تمیز کردن فلزات کاربرد دارند.
- مثال: استفاده از اسید فسفریک برای پاک سازی آهن و فولاد.
- تولید انرژی و باتری ها: اسید سولفوریک در باتری های سرب-اسیدی مورد استفاده در خودروها به کار می رود.
- فرآوری نفت و گاز: در پالایشگاه ها از اسیدها برای حذف ناخالصی ها و جداسازی ترکیبات استفاده می شود.
کاربردها در زندگی روزمره
- استفاده در مواد غذایی: اسیدها به عنوان مواد نگهدارنده، طعم دهنده و تنظیم کننده pH در غذاها استفاده می شوند. بوطر مثال اسید سیتریک در نوشیدنی ها و آب میوه ها. اسید استیک (سرکه) به عنوان چاشنی و نگهدارنده.
- مراقبت های بهداشتی و دارویی: اسیدها در تولید داروها، محصولات بهداشتی و مکمل های غذایی نقش دارند همچون اسکوربیک اسید (ویتامین C) برای تقویت سیستم ایمنی. تولید آنتی بیوتیک ها و داروهای ضد التهاب با کمک اسیدهای خاص.
- نظافت و تمیزکاری: اسیدها در تولید مواد شوینده و پاک کننده کاربرد دارند مثل اسید هیدروکلریک در جرم گیری و تمیزکاری کاشی و سرامیک.
- آرایشی و بهداشتی: برخی اسیدها در محصولات زیبایی و مراقبتی استفاده می شوند همچون اسید هیالورونیک برای رطوبت رسانی به پوست یا اسید گلیکولیک برای لایه برداری پوست.
نقش اسیدها در طبیعت
- چرخه های زیستی: اسیدها در چرخه های طبیعی مانند چرخه نیتروژن و چرخه کربن نقش کلیدی دارند. مثلا تولید اسید کربنیک در آب باران و کمک به تجزیه سنگ ها.
- فرآیند گوارش: اسید هیدروکلریک در معده به هضم غذا و نابودی باکتری ها کمک می کند.
- تنظیم pH محیط: اسیدها در تنظیم pH خاک و آب ها برای رشد بهتر گیاهان نقش دارند.
کاربردها در محیط زیست و مشکلات مرتبط
- باران اسیدی: انتشار گازهای اکسید نیتروژن و گوگرد از فعالیت های صنعتی موجب تشکیل اسید در جو می شود که می تواند به تخریب زیست محیطی منجر شود.
- تجزیه مواد: اسیدهای طبیعی موجود در محیط به تجزیه مواد آلی و غیرآلی کمک می کنند.
طبقه بندی اسیدها
اسیدها به دو دسته اصلی اسیدهای معدنی و اسیدهای آلی تقسیم می شوند. این دو گروه بر اساس ترکیب شیمیایی و منبع تولیدشان با یکدیگر تفاوت دارند. هر دو نوع اسید، معدنی و آلی، در شیمی و زندگی روزمره نقش مهمی دارند. اسیدهای معدنی بیشتر در صنایع سنگین و شیمیایی استفاده می شوند، در حالی که اسیدهای آلی در محصولات غذایی، دارویی و زیستی اهمیت دارند. در ادامه به بررسی هر کدام می پردازیم:
اسیدهای معدنی
اسیدهای معدنی ترکیبات شیمیایی هستند که از مواد معدنی یا غیرآلی (غیرکربنی) به دست می آیند. این اسیدها معمولاً از هیدروژن به همراه یک یا چند عنصر دیگر (مانند کلر، گوگرد یا فسفر) تشکیل شده اند. اغلب قوی تر از اسیدهای آلی هستند، در آب به خوبی حل می شوند و یون +H آزاد می کنند، معمولاً خورنده تر هستند و در صنایع مختلف کاربرد فراوان دارند.
مثال ها:
- هیدروکلریک اسید (HCl): کاربرد این اسید جرم گیری، تصفیه فلزات، تولید مواد شیمیایی.
- سولفوریک اسید (H₂SO₄): تولید باتری، کودهای شیمیایی و مواد شوینده.
- نیتریک اسید (HNO₃): تولید کود، مواد منفجره و صنایع شیمیایی.
- فسفریک اسید (H₃PO₄): تولید نوشیدنی های گازدار، کود و مواد شوینده.
اسیدهای آلی
اسیدهای آلی ترکیبات شیمیایی هستند که در ساختار آن ها عنصر کربن وجود دارد و اغلب از منابع طبیعی (مانند گیاهان و حیوانات) به دست می آیند. این اسیدها حاوی گروه کربوکسیل [−COOH] هستند. معمولاً ضعیف تر از اسیدهای معدنی هستند، در موجودات زنده وجود دارند و در متابولیسم بدن نقش دارند، خورندگی کمتری دارند و در صنایع غذایی و دارویی کاربرد زیادی دارند.
مثال ها:
- استیک اسید (CH₃COOH):کاربرد این نوع اسید در سرکه، تولید مواد شیمیایی و پلاستیک ها.
- سیتریک اسید: موجود در مرکبات، تنظیم کننده pH و طعم دهنده در غذاها.
- اسکوربیک اسید (ویتامین C): مکمل غذایی و تقویت سیستم ایمنی.
- لاکتیک اسید: در محصولات لبنی و فرآیندهای تخمیر.
- اگزالیک اسید: در برخی گیاهان مانند اسفناج، تمیز کردن زنگ فلزات.
تفاوت بین اسیدهای معدنی و آلی
| ویژگی | اسیدهای معدنی | اسیدهای آلی |
| ترکیب شیمیایی | فاقد کربن | دارای کربن |
| قدرت اسیدی | معمولاً قوی تر | معمولاً ضعیف تر |
| منبع | مواد معدنی و غیرآلی | منابع طبیعی و آلی |
| خورندگی | اغلب خورنده تر | کمتر خورنده |
| حل شدن در آب | به خوبی حل می شوند | حل پذیری کمتر (برخی نامحلول) |
| کاربرد | صنایع سنگین، شیمیایی | صنایع غذایی و دارویی |
گاهی از ترکیب اسیدهای معدنی و آلی برای تولید مواد شیمیایی پیشرفته استفاده می شود. به عنوان مثال:
- ترکیب استرها از واکنش اسید سولفوریک و اسیدهای آلی.
- استفاده از اسید سیتریک در تنظیم pH محلول های معدنی.
میزان اسیدیته اسیدها
اسیدها بر اساس توانایی شان در یونیزه شدن و آزاد کردن یون هیدروژن (+H) در آب، به دو دسته اسیدهای قوی و اسیدهای ضعیف تقسیم می شوند. این تقسیم بندی به میزان تفکیک (یونیزاسیون) مولکول های اسید در محلول آبی بستگی دارد.
اسیدهای قوی
اسیدهایی که در محلول آبی به طور کامل به یون های +H و آنیون مربوطه (مانند Cl⁻ یا SO₄²⁻) تفکیک می شوند، اسیدهای قوی نامیده می شوند. در این اسیدها، تقریباً تمامی مولکول های اسید به یون تبدیل می شوند. pH آن ها بسیار پایین است (1 یا کمتر). بسیار خورنده و واکنش پذیر هستند. قدرت تفکیک آن ها تقریباً 100% است. رسانایی الکتریکی بالایی در محلول دارند.
مثال ها:
- هیدروکلریک اسید (HCl): تمیز کردن فلزات، تولید مواد شیمیایی.
- سولفوریک اسید (H₂SO₄): تولید باتری، کودهای شیمیایی.
- نیتریک اسید (HNO₃): تولید کود، مواد منفجره.
- پروکلریک اسید (HClO₄): در صنایع شیمیایی خاص.
- هیدروبرومیک اسید (HBr) و هیدرویدیک اسید (HI): سنتزهای شیمیایی.
اسیدهای ضعیف
اسیدهایی که در محلول آبی فقط به صورت جزئی یونیزه می شوند و بخشی از مولکول های آن ها به صورت دست نخورده باقی می ماند، اسیدهای ضعیف نامیده می شوند. pH آنها بین 3 تا 7 است. خورندگی کمتری دارند. قدرت تفکیک آن ها کم است (معمولاً کمتر از 5%). رسانایی الکتریکی ضعیفی در محلول دارند.
مثال ها:
- استیک اسید (CH₃COOH): سرکه و تولید مواد شیمیایی.
- کربنیک اسید (H₂CO₃): در نوشابه های گازدار.
- فسفریک اسید (H₃PO₄): تنظیم کننده pH در مواد غذایی.
- لاکتیک اسید: در محصولات لبنی و مکمل های ورزشی.
- اگزالیک اسید: در پاک کننده ها و برخی گیاهان.
در ادامه جدولی تفاوت بین اسیدهای قوی و ضعیف را مشاهده خواهید نمود:
| ویژگی | اسیدهای قوی | اسیدهای ضعیف |
| تفکیک در آب | تقریباً کامل | جزئی |
| pH | بسیار پایین (1 یا کمتر) | بین 3 تا 7 |
| خورندگی | بسیار خورنده | کمتر خورنده |
| رسانایی الکتریکی | بسیار بالا | کمتر |
| غلظت یون +H | بسیار زیاد | کمتر |
| مثال ها | HCl، H₂SO₄، HNO₃ | CH₃COOH، H₂CO₃، H₃PO₄ |
اندازه گیری قدرت اسیدها (Ka و pKa)
- Ka (ثابت تفکیک اسید): نشان دهنده قدرت یک اسید در محلول است. هر چه مقدار Ka بیشتر باشد، اسید قوی تر است.
- pKa: لگاریتم معکوس Ka است. اسیدهای قوی pKa کوچک تر (یا منفی) دارند، در حالی که اسیدهای ضعیف pKa بزرگ تر دارند.
اسیدهای قوی در صنایع سنگین و واکنش های شیمیایی خاص و اسیدهای ضعیف در صنایع غذایی، داروسازی، و کاربردهای خانگی مورد استفاده قرار می گیرند.
تعداد پروتون اسیدها
اسیدها را می توان بر اساس تعداد پروتون هایی (+H) که می توانند در واکنش با بازها یا در محلول آبی آزاد کنند، به دو دسته کلی تک پروتونی و چندپروتونی تقسیم کرد.
اسیدهای تک پروتونی
اسیدهایی که تنها یک پروتون (+H) در هر مولکول خود آزاد می کنند، اسیدهای تک پروتونی نامیده می شوند. این اسیدها فقط یک مرحله واکنش تفکیک دارند و ساده ترین نوع اسیدها از نظر واکنش با بازها هستند.
مثال ها:
- هیدروکلریک اسید (HCl):
- تفکیک: –Cl + +H →HCl
- نیتریک اسید (HNO₃):
- تفکیک: –3NO + +H →3HNO
- استیک اسید (CH₃COOH):
- تفکیک: ↔3HNO –CH 3COO + +H
اسیدهای چند پروتونی
اسیدهایی که می توانند بیش از یک پروتون (+H) آزاد کنند، اسیدهای چند پروتونی نامیده می شوند. این اسیدها در مراحل جداگانه و با یونیزاسیون مرحله ای پروتون های خود را آزاد می کنند. به صورت مرحله ای تفکیک می شوند و هر مرحله تفکیک سخت تر از مرحله قبلی است؛ یعنی در هر مرحله، قدرت اسید کاهش می یابد. این نوع اسیدها به دو زیرگروه تقسیم می شوند:
- دوپروتونی: می توانند 2 پروتون آزاد کنند.
- سه پروتونی: می توانند 3 پروتون آزاد کنند.
اسیدهای دو پروتونی:
- کربنیک اسید (H₂CO₃):
-
- تفکیک مرحله اول: –3HCO + +H ↔3H 2CO
- تفکیک مرحله دوم: -23CO + +H ↔3–HCO
- سولفوریک اسید (H₂SO₄):
-
- تفکیک مرحله اول: –4HSO + +H →4H 2SO (قوی)
- تفکیک مرحله دوم: -24SO + +H ↔4–HSO (ضعیف)
اسیدهای سه پروتونی:
- فسفریک اسید (H₃PO₄):
-
- تفکیک مرحله اول: –4H 2PO + +H ↔4H 3PO
- تفکیک مرحله دوم: -24HPO + +H ↔4–H 2PO
- تفکیک مرحله سوم: -34PO + +H ↔4-2HPO
جدول مقایسه اسیدهای تک پروتونی و چند پروتونی را در ادامه مشاهده می کنید.
| ویژگی | اسیدهای تک پروتونی | اسیدهای چندپروتونی |
| تعداد پروتون های آزاد شده | یک پروتون | بیش از یک پروتون |
| تفکیک | یک مرحله | چند مرحله |
| پیچیدگی واکنش | ساده | پیچیده تر |
| قدرت اسید | بسته به نوع اسید | قدرت هر مرحله کاهش می یابد |
| مثال ها | HCl ، HNO₃ ، CH₃COOH | H₂SO₄ ، H₃PO₄ ، H₂CO₃ |
اسیدهای تک پروتونی در فرآیندهای ساده شیمیایی و خنثی سازی سریع؛ همچون هیدروکلریک اسید در تمیز کردن فلزات و اسیدهای چندپروتونی در واکنش های پیچیده شیمیایی و تولید ترکیبات چندپایه ای (مانند کودها). بطور مثال فسفریک اسید در تولید کودهای فسفاته و نوشیدنی های گازدار کاربرد دارند.
اسیدهای تک پروتونی ساده تر و معمولاً قوی تر هستند، در حالی که اسیدهای چندپروتونی کاربردهای گسترده تری دارند و در واکنش های زیستی و صنعتی اهمیت زیادی پیدا می کنند. انتخاب نوع اسید بسته به نیاز فرآیند شیمیایی و ویژگی های ماده مورد نظر صورت می گیرد.
تفاوت های اسیدهای معدنی و آلی
با توجه به ساختار متفاوت انواع اسیدها، این مواد شیمیایی در ساختار، واکنش پذیری و نحوه ذخیره سازی یا حمل متفاوت هستند که در ادامه آنها را توضیح خواهیم داد؛ با ما همراه باشید:
تفاوت در ساختار
- اسیدهای معدنی معمولاً ساختار ساده تری دارند و از ترکیب هیدروژن با یک عنصر معدنی یا گروه های غیرآلی دیگر تشکیل شده اند. اسیدهای آلی به طور عمده از کربن، هیدروژن و اکسیژن تشکیل شده اند و دارای گروه کربوکسیل (-COOH) هستند که در بسیاری از موارد ساختار پیچیده تری دارند.
- اسیدهای معدنی عموماً هیچ اتم کربنی ندارند (مانند HCl، H₂SO₄) یا در موارد کمی دارای کربن هستند. اسیدهای آلی همیشه حداقل یک اتم کربن دارند و معمولاً مولکول های کربن بیشتری را شامل می شوند.
- اسیدهای معدنی بیشتر از مواد معدنی و غیرآلی استخراج می شوند. اسیدهای آلی معمولاً از منابع طبیعی زیستی (گیاهان یا حیوانات) به دست می آیند.
تفاوت در واکنش پذیری
اسیدهای معدنی و آلی از نظر واکنش پذیری نیز تفاوتهای قابل توجهی دارند. این تفاوت ها به ویژه به دلیل ساختار شیمیایی متفاوت این دو گروه اسیدها ناشی می شود.
- اسیدهای معدنی به طور کلی از واکنش پذیری بیشتری برخوردار هستند، به ویژه با فلزات و بازها. اسیدهای آلی نسبت به اسیدهای معدنی کمتر واکنش پذیرند و بیشتر در واکنش های زیستی و خاص شیمیایی استفاده می شوند.
- نوع واکنش ها: اسیدهای معدنی معمولاً واکنش های اسیدی-باز ساده تری دارند و به طور عمومی خورنده تر هستند. اسیدهای آلی معمولاً در واکنش های پیچیده تری مانند استری شدن، تخمیر یا واکنش های زیستی و شیمیایی خاص شرکت می کنند.
- خورندگی: اسیدهای معدنی معمولاً خورنده تر و خطرناک تر از اسیدهای آلی هستند.
در ادامه به تفکیک در مورد تفاوت های انواع اسیدهای آلی و معدنی در قدرت واکنش پذیری و نوع آن توضیحاتی ارائه خواهد گردید؛ با ما همراه باشید:
اسیدهای معدنی:
- واکنش پذیری بالا: اسیدهای معدنی معمولاً واکنش پذیرتر هستند و در بسیاری از شرایط می توانند به راحتی واکنش دهند. این اسیدها به طور عمومی دارای خاصیت خورندگی بالایی هستند.
- واکنش با فلزات: اسیدهای معدنی مانند HCl ، H₂SO₄ و HNO₃ به راحتی با فلزات واکنش می دهند و گاز هیدروژن (H₂) تولید می کنند.
- واکنش با بازها: اسیدهای معدنی به راحتی با بازها واکنش می دهند و نمکهای معدنی تشکیل می دهند.
- اسیدهای قوی: بسیاری از اسیدهای معدنی (مثل HCl و H₂SO₄) اسیدهای قوی هستند و می توانند در غلظت های بالا به سرعت واکنش های شیمیایی را تحریک کنند.
اسیدهای آلی:
- واکنش پذیری کمتر: اسیدهای آلی به طور کلی نسبت به اسیدهای معدنی واکنش پذیری کمتری دارند. این اسیدها به خاطر ساختار پیچیده تر و حضور گروههای کربنی، معمولاً در شرایط خاصی واکنش نشان می دهند.
- واکنش با بازها: اسیدهای آلی مانند اسید استیک (CH₃COOH) با بازها واکنش می دهند و نمک های آلی (استات ها) تولید می کنند.
- واکنش های تخمیر و بیولوژیکی: اسیدهای آلی در فرآیندهای بیولوژیکی مانند تخمیر و متابولیسم شرکت می کنند. این اسیدها معمولاً در واکنش های زیستی (مثل تولید انرژی در بدن) فعال تر هستند.
- واکنش با مواد شیمیایی خاص: اسیدهای آلی معمولاً در واکنش های خاص مانند نیتراسیون یا استری شدن با الکل ها به کار می روند.
تفاوت در پایداری و ذخیره سازی
اسیدهای معدنی:
- اسیدهای معدنی معمولاً بسیار پایدار هستند و در شرایط معمولی تغییرات شیمیایی زیادی نمی دهند.
- آنها در دماهای مختلف و در شرایط نوری معمولی به خوبی پایدار می مانند.
- این اسیدها می توانند در واکنش با مواد دیگر یا مواد قابل اشتعال به سرعت تغییر کنند. مثلاً اسید سولفوریک می تواند در دماهای بالا به راحتی مواد آلی را تجزیه کند.
- اسیدهای معدنی قوی مانند HCl یا H₂SO₄ معمولاً به راحتی با مواد دیگر واکنش نشان می دهند، به ویژه با فلزات، که در صورت تماس ممکن است تولید هیدروژن کنند.
- اسیدهای معدنی باید در ظروف مقاوم به خوردگی نگهداری شوند.
- ظرف های معمول برای ذخیره سازی این اسیدها معمولاً از مخازن پلی اتیلنی و پلی پروپیلنی و یا شیشه های مقاوم به اسید استفاده می شود.
- ذخیره سازی در دمای اتاق معمولاً کافی است، اما در صورت نیاز به ذخیره سازی طولانی مدت، دما باید کنترل شود تا از تأثیرات نامطلوب بر مواد جلوگیری شود.
- ذخیره سازی در مکان های با تهویه مناسب ضروری است تا از تجمع بخارات اسیدی جلوگیری شود.
- باید از قرار دادن این اسیدها در مناطق نزدیک به مواد آلی، مواد قابل اشتعال یا فلزات جلوگیری کرد.
اسیدهای آلی:
- معمولاً پایدارتر از اسیدهای معدنی هستند، اما این پایداری بستگی به نوع اسید و شرایط محیطی دارد. به عنوان مثال، اسید استیک (CH₃COOH) در دمای معمولی به طور نسبی پایدار است.
- بعضی از اسیدهای آلی مانند اسید سیتریک و اسید لاکتیک در شرایط محیطی خاص ممکن است دچار تجزیه شوند یا تغییرات شیمیایی داشته باشند.
- اسیدهای آلی به طور کلی نسبت به اسیدهای معدنی کمتر واکنش پذیرند، اما برخی از آنها ممکن است در دماهای بالا یا در معرض نور تجزیه شوند.
- اسیدهای آلی به طور معمول در ظروف پلاستیکی یا شیشه ای غیرقابل نفوذ نگهداری می شوند. ظروف باید به طور کامل مهر و موم شده باشند تا از ورود هوا جلوگیری کنند.
- ذخیره سازی در دمای اتاق مناسب است، اما برای برخی از اسیدهای آلی خاص (مانند اسید لاکتیک یا اسید سیتریک) ممکن است نیاز به ذخیره سازی در یخچال یا دمای پایین تر باشد.
- بیشتر اسیدهای آلی نسبت به اسیدهای معدنی بخارات کمتری تولید می کنند، اما همچنان باید در محیط های با تهویه مناسب نگهداری شوند.
- اسیدهای آلی معمولاً نباید در معرض نور مستقیم قرار بگیرند و باید از قرار دادن آنها در نزدیکی مواد متشکل از فلزات یا منابع گرما اجتناب کرد.
نکات ایمنی در حمل و نقل و نگهداری اسیدها
- حمل و نقل: اسیدها باید در ظروف مقاوم و با برچسب های ایمنی حمل شوند. از پوشش ایمنی مثل دستکش و عینک استفاده شده و باید در محیط تهویه دار جابجا شوند.
- نگهداری: اسیدها باید در ظروف مقاوم به خوردگی، محل های خشک و خنک و دور از منابع حرارت و مواد آلی نگهداری شوند. تهویه مناسب و جلوگیری از آمیختن اسیدها نیز اهمیت دارد. نگهداری هر یک از اسیدها مستلزم استفاده از مخزن اسید خاصی است.
- ایمنی: کارکنان باید در روش های ایمنی و استفاده از تجهیزات حفاظتی آموزش ببینند. در صورت نشت اسید، باید از مواد خنثی کننده استفاده و فوراً تماس با آب زیاد صورت گیرد.
اثرات اسیدها بر محیط زیست
اسیدها با آلودگی آب، خاک و هوا و ایجاد باران های اسیدی به محیط زیست آسیب می زنند و باید به طور ایمن ذخیره و مدیریت شوند. اسیدها می توانند اثرات مخربی بر محیط زیست داشته باشند، از جمله:
- آلودگی آب: ریختن اسیدها در آب می تواند پی اچ آب را کاهش دهد و باعث آسیب به موجودات آبزی شود.
- آلودگی خاک: اسیدهای ریخته شده روی خاک می توانند ساختار خاک را تغییر داده و باعث کاهش حاصلخیزی خاک شوند.
- تخریب پوشش گیاهی: اسیدها می توانند باعث آسیب به گیاهان شده و در رشد آنها اختلال ایجاد کنند.
- باران های اسیدی: ترکیب اسیدها با گازهای آلاینده در جو باعث باران های اسیدی می شود که به محیط زیست آسیب می زند.
- آلودگی هوا: اسیدهای فرار مانند HCl می توانند به آلودگی هوا و آسیب به سلامتی انسانها و موجودات زنده منجر شوند.
اهمیت شناخت درست از اسیدها
آگاهی و دقت در استفاده از اسیدها نه تنها ایمنی را تضمین می کند بلکه به حفظ سلامت محیط زیست و کاربرد مؤثرتر کمک می کند. شناخت و استفاده درست از اسیدها اهمیت زیادی دارد زیرا:
- اسیدها می توانند خطرات جدی مانند سوختگی، آسیب به پوست و چشم ها و آلودگی محیط زیست ایجاد کنند. استفاده صحیح و آگاهی از روش های ایمنی می تواند این خطرات را کاهش دهد.
- استفاده درست از اسیدها در صنعت، کشاورزی و علوم پزشکی باعث بهره وری بیشتر و نتایج مطلوب می شود.
- استفاده صحیح و کنترل شده از اسیدها می تواند از آلودگی خاک، آب و هوا جلوگیری کرده و اثرات منفی بر اکوسیستم را کاهش دهد.
- شناخت انواع اسیدها و کاربرد صحیح آنها باعث می شود که از آسیب به منابع طبیعی جلوگیری و منابع را به طور پایدار استفاده کنیم.
پارامترهای تاثیرگذار بر قیمت اسیدها
قیمت اسیدها تحت تأثیر عوامل مختلفی قرار دارد که می توان آن ها را در چند دسته اصلی بررسی کرد:
- نوع و خلوص اسید
- اسیدهای قوی مانند اسید سولفوریک و اسید نیتریک معمولاً قیمت متفاوتی نسبت به اسیدهای ضعیف دارند.
- درجه خلوص اسید تأثیر مستقیمی بر قیمت دارد؛ هرچه اسید خالص تر باشد، قیمت آن بالاتر خواهد بود.
- روش تولید و منابع تأمین
- اسیدهایی که از مواد اولیه طبیعی مانند سنگ های معدنی یا گازهای صنعتی استخراج می شوند، هزینه تولید متفاوتی نسبت به اسیدهای سنتزی دارند.
- تکنولوژی تولید و تجهیزات مورد استفاده در فرآیند تولید نیز بر هزینه نهایی تأثیرگذار است.
- حجم و بسته بندی
- قیمت اسیدها بر اساس حجم خریداری شده متغیر است؛ معمولاً خرید عمده هزینه کمتری نسبت به بسته بندی های کوچک دارد.
- نوع بسته بندی (بطری های پلاستیکی، بشکه های فلزی یا تانکرهای حمل اسید) نیز در تعیین قیمت تأثیر دارد.
- هزینه های حمل و نقل
- اسیدها اغلب مواد خطرناکی هستند و نیاز به شرایط ویژه حمل و نقل دارند که می تواند هزینه ها را افزایش دهد.
- فاصله بین محل تولید و محل مصرف نیز بر هزینه نهایی تأثیرگذار است.
- نوسانات بازار و قیمت مواد اولیه
- قیمت مواد اولیه مورد استفاده در تولید اسیدها، مانند گوگرد، کلر، یا نفت خام، بر قیمت نهایی اسید تأثیر می گذارد.
- نوسانات بازارهای بین المللی، نرخ ارز و تعرفه های وارداتی و صادراتی نیز عامل مهمی در تعیین قیمت است.
- عرضه و تقاضا
- میزان تقاضا در صنایع مختلف مانند کشاورزی، داروسازی و تصفیه آب بر قیمت اسیدها اثرگذار است.
- محدودیت های تولید و عرضه (مثلاً به دلیل تحریم ها یا مشکلات تولید) نیز می تواند قیمت را افزایش دهد.
- مقررات زیست محیطی و ایمنی
- برخی اسیدها تحت مقررات سختگیرانه زیست محیطی قرار دارند که هزینه های اضافی برای تولیدکنندگان ایجاد می کند.
- الزام به استانداردهای ایمنی بالا در تولید، حمل و ذخیره سازی نیز می تواند بر قیمت تأثیرگذار باشد.
در مجموع، قیمت اسیدها به ترکیبی از عوامل فنی، اقتصادی و تجاری بستگی دارد و ممکن است در بازه های زمانی مختلف دچار تغییرات شود.
در انتها پیشنهاد می نمائیم صفحات زیر را نیز بازدید فرمائید: