اسید سولفوریک، جوهر گوگرد یا سولفات هیدروژن ماده ای سمی با فرمول شیمیایی H₂So₄ و در صورت استنشاق یا بلعیده شدن میتواند سبب مرگ شود. در صورت تماس با پوست سبب زخم و سوختگی عمیق و در صورت تماس با چشم سبب کوری در فرد می شود. این ماده دارای مولکول های دارای گشتاور قطبی است که می توانند با یکدیگر پیوند هیدروژنی برقرار کنند.
اسید سولفوریک چیست؟
این ماده شیمیایی مایعی است با نقطه جوش بالا و هم چنین یک مایع ویسکوز (دارای گران روی زیاد) محسوب می شود. همین شرایط مولکولی باعث می شوند که این ماده به خوبی در آب حل شود و محلول های اسیدی مختلف تولید کند.
سولفوریک اسیدها، یکی از مهمترین مواد شیمیایی موجود در جهان محسوب می شوند. این ماده شیمیایی، اسیدی بسیار قوی و در زمره مواد شیمیایی بسیار خطرناک قرار می گیرد. این ماده بی رنگ، خورنده و واکنش پذیر است و با هر درصدی در آب حل میشود. دارای نقطه ذوب 10 و نقطه جوش 335 درجه سانتیگراد می باشد.
در گذشته با نام جوهر گوگرد خوانده می شد. اسید سولفوریک برای نخستین بار توسط جابربن حیان کشف شد.
خواص فیزیکی و شیمیایی سولفوریک اسید
در یکی نگاه اجمالی خصوصیات فیزیکی و شیمیایی اسید سولفوریک به شرح زیر میباشد.
خواص فیزیکی
- مایع بیرنگ و غلیظ
- بدون بو
- چگالی 1.84 گرم بر سانتیمتر مکعب
- نقطه ذوب 10.3 درجه سانتیگراد
- نقطه جوش 338 درجه سانتیگراد
- حلالیت به طور کامل در آب حل میشود
- ویسکوزیته بالا
خواص شیمیایی
- به راحتی یون هیدروژن (H+) آزاد میکند و pH پایینی دارد یعنی اسیدی بسیار قوی محسوب میشود.
- به دلیل اسیدی قوی بودن، میتواند فلزات و بافتهای زنده را خراب کند.
- به شدت رطوبت هوا را جذب میکند و میتواند باعث گرم شدن و پاشیدن اسید شود.
- میتواند در برخی واکنشها به عنوان عامل اکسنده عمل کند.
- هنگام مخلوط شدن با آب، گرمای زیادی تولید میکند.
نگهداری اسید سولفوریک
بمنظور نگهداری اسید سولفوریک، حمل و یا تقسیم به واحدهای کوچکتر نمودن این نوع اسید از تانکرهای استیل، پلی اتیلنی و یا پلی پروپیلن استفاده می گردد.
- در صورتی که اسید سولفوریک 98% در اختیار شماست و دمای آن بیشتر از 85 درجه سانتیگراد باشد و قصد انبارش آن را دارید حتما از مخزن استیل 316 می بایست استفاده کنید.
- در صورتی که اسید کمتر از 90% در اختیار دارید و دمای آن کمتر از 65 درجه سانتیگراد می باشد می توانید از مخزن اسید با جنس بدنه پلی پروپیلن استفاده نمائید.
- و در صورتی که اسید سولفوریک شما دمایی کمتر از 50 درجه دارد و یا غلظت آن کمتر از 60% باشد می بایست از مخزن پلی اتیلن جهت انبارش اسید مذکور استفاده نمایید.
کاربردهای سولفوریک اسید
اسید سولفوریک به عنوان شاه اسیدها در دنیای صنعت شناخته میشود. این اسید مایعی بیرنگ، بیبو و با چگالی بالا است که به دلیل خواص شیمیایی منحصر به فرد خود، کاربردهای گستردهای در صنایع مختلف دارد. در ادامه به برخی از کاربردهای آن اشاره میکنیم:
- در تولید کودهای شیمیایی، به خصوص سوپر فسفات آمونیوم و سولفات آمونیوم که برای رشد گیاهان ضروری هستند، نقش کلیدی دارد. بدون این اسید، تولید غذای کافی برای جمعیت رو به رشد جهان دشوار خواهد بود.
- در تصفیه فاضلاب و حذف آلایندهها و فلزات سنگین از آن نقش مهمی ایفا میکند. تصفیه مناسب فاضلاب برای حفظ سلامت محیط زیست و جلوگیری از آلودگی آبهای زیرزمینی ضروری است.
- در تولید طیف وسیعی از مواد شیمیایی از جمله اسید نیتریک، اسید هیدروکلریک، رنگدانهها، مواد شوینده و حشرهکشها کاربرد دارد. این مواد شیمیایی در صنایع مختلف از جمله کشاورزی، نساجی و ساخت و ساز به کار میروند.
- در پالایشگاههای نفت برای تصفیه و جداسازی ناخالصیهای نفت خام و تولید محصولات نفتی مانند بنزین، گازوئیل و نفت کوره به کار میرود
- در تولید باتری و آب باتری اتومبیل خودروها و سایر وسایل نقلیه استفاده میشود.
- در فرآیندهای مختلف تولید پارچه از جمله رنگرزی، تکمیل و چاپ به کار میرود. این ماده به افزایش کیفیت و تنوع پارچهها کمک میکند.
- در استخراج فلزاتی مانند مس، روی، اورانیوم، وانادیوم و سرب از سنگ معدن به کار میرود. این اسید به جداسازی فلزات از ناخالصیها و سنگ معدن کمک میکند.
- در فرآیند تولید کاغذ (دستمال کاغذی، روزنامه، جعبههای مقوایی، کاغذ تحریر و سایر مقواها) برای خمیر کردن چوب و جداسازی ناخالصیها به کار میرود. همچنین به تولید کاغذ با کیفیت و مقاوم کمک میکند.
- برای تصفیه آب و حذف ناخالصیها و فلزات سنگین از آن به کار میرود. تصفیه مناسب آب برای سلامتی انسان و حفظ محیط زیست ضروری است.
- اسید سولفوریک خوراکی از پختن تری اکسید گوگرد ساخته میشود و ماده اولیه در تولید آن گوگرد میباشد. به علت کاربرد فراوان و گسترده این اسید، سالیانه حدود 180 میلیون تن اسید سولفوریک خوراکی در جهان تولید و جهت جلوگیری از رشد باکتری و میکروبهای مضر درون مواد غذایی استفاده میشود.
- صنایع فولاد و آهن (محصول جانبی صنعت فولاد و رسوب زدایی)
- صنایع شیمیایی (ضد یخ، حشره کشها، داروها، احیای آلومینیوم)
- تولید مواد شوینده (به عنوان حلال چربی ها و لیپیدها)
- تولید مواد منفجره (ماننده تی ان تی)
- حفاری چاههای نفت (اسیدی کردن چاههای نفت)
- مواد رنگی (نایلون رنگی، جوهر تحریر و تهیه TiO2 از ایلمنیت)
- ابریشم مصنوعی و فیلم (پارچههای ابریشمی، نخ اطراف تایر و فیلمهای عکاسی)
- فرآیند آنودایزینگ آلومینیوم از غلظت های متفاوت این اسید به عنوان ماده الکترولیت
ساختار شیمیایی اسید سولفوریک
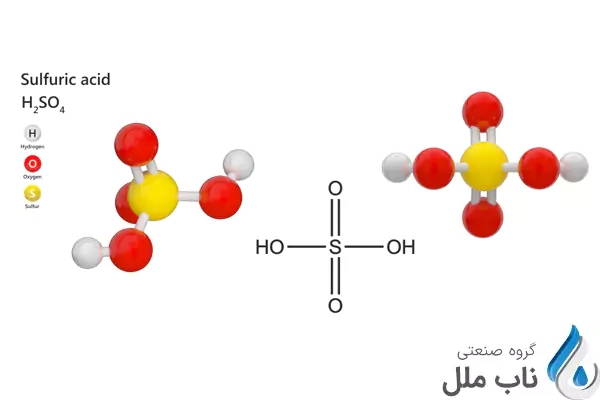
اسید سولفوریک با فرمول شیمیایی H2SO4، از یک اتم گوگرد، چهار اتم اکسیژن و دو اتم هیدروژن تشکیل شده است. ساختار مولکولی این اسید به صورت زیر است:
O|S(=O)2|OH
در این ساختار، اتم گوگرد در مرکز مولکول قرار دارد و با چهار اتم اکسیژن پیوند کووالانسی برقرار کرده است. دو اتم هیدروژن نیز به دو اتم اکسیژن دیگر متصل هستند. اسید سولفوریک یک اسید دوپایه است، به این معنی که میتواند دو یون هیدروژن (H+) از دست بدهد.
اولین تفکیک اسید سولفوریک به صورت زیر است:
H2SO4 + H2O ⇌ HSO4- + H3O+
در این واکنش، یک اتم هیدروژن از سولفوریک اسید جدا شده و به مولکول آب پیوند میدهد و یون هیدروژن (H+) و یون هیدروژن سولفات (HSO4-) را تشکیل میدهد.
دومین تفکیک اسید سولفوریک به صورت زیر است:
HSO4- + H2O ⇌ SO42- + H3O+
در این واکنش، اتم هیدروژن دیگر از یون هیدروژن سولفات جدا شده و به مولکول آب پیوند میدهد و یون هیدروژن (H+) و یون سولفات (SO42-) را تشکیل میدهد.
روشهای تولید اسید سولفوریک
امروزه، دو روش اصلی (تماسی و مرطوب) و دو روش غیر تجاری (روش الکتروشیمیایی و روش مستقیم) برای تولید اسید سولفوریک در جهان وجود دارد. انتخاب روش مناسب به عوامل مختلفی مانند ظرفیت تولید، غلظت مورد نظر اسید، هزینهها و مسائل زیستمحیطی بستگی دارد.
تولید اسید سولفوریک به روش تماسی
روش تماسی تولید این اسید پرکاربرد در صنعت و کشاورزی شامل سه مرحله است؛
- گوگرد ذوب شده و در مجاورت هوای گرم سوزانده میشود تا گاز دیاکسید گوگرد (SO2) تولید شود.
- گاز SO2 در حضور کاتالیزور (پنتا اکسید وانادیوم) و با عبور از برجهای مبدل، به گاز تریاکسید گوگرد (SO3) تبدیل میشود.
- گاز SO3 در برج جذب، جذب آب شده با آن واکنش داده و اسید سولفوریک با غلظتهای مختلف تولید میشود.
مزایای این روش؛ راندمان بالا، تولید اسید با غلظت بالا، آلایندگی کمتر و معایب آن نیاز به کاتالیزور و هزینه سرمایهگذاری بالا می باشد.
تولید اسید سولفوریک به روش مرطوب
روش مرطوب که خود شامل دو مرحله است؛
- سولفید فلزاتی مانند پیریت (FeS2) در مجاورت هوا سوزانده یا اکسید شده و گاز SO2 تولید میشود.
- گاز SO2 در برجهای جذب، با اسید سولفوریک رقیق واکنش داده و اسید با غلظتهای مختلف تولید میشود.
مزایای این روش شامل هزینه سرمایهگذاری پایین و عدم نیاز به کاتالیزور و معایب آن شامل راندمان پایین، تولید اسید با غلظت پایین و آلایندگی بیشتر میباشد.
علاوه بر دو روش ذکر شده، روشهای دیگری نیز برای تولید این اسید وجود دارند که به دلیل راندمان پایین یا آلایندگی زیاد، کاربرد کمتری دارند.
- در روش تولید به صورت مستقیم، گوگرد با اکسیژن در یک راکتور پلاسمایی واکنش داده و مستقیماً اسید سولفوریک تولید میشود. این روش هنوز در تب و تاب توسعه است و به طور تجاری به کار نمیرود.
- در روش تولید به صورت الکتروشیمیایی گاز SO2 در یک سلول الکترولیتی به SO3 تبدیل میشود. این روش راندمان بالایی دارد، اما هزینه سرمایهگذاری آن بالا است.
مهمترین کارخانههای تولید اسید سولفوریک عبارتند از: اسید نوین گستران ارومیه، اسیدسازان زنجان، مجتمع مس سرچشمه، پتروشیمی رازی، مجتمع مس شهر بابک و کیمیا داران کویر یزد
خطرات اسید سولفوریک
- اسید سولفوریک به شدت خورنده است و میتواند به سرعت به پوست، چشم، فلزات و سایر مواد آسیب برساند. تماس مستقیم با این اسید، منجر به سوختگیهای شیمیایی دردناک و گاه جبرانناپذیر میشود.
- استنشاق بخارات آن میتواند باعث تحریک و التهاب دستگاه تنفسی، سرفه، تنگی نفس و در موارد شدید، آسیب دائمی به ریهها شود. بلعیدن این اسید نیز به شدت سمی و حتی کشنده است.
- این اسید در هنگام رقیق شدن با آب، گرمای زیادی تولید میکند. این گرما میتواند باعث پاشیدن و سوختگی شود.
- سولفوریک اسید در هنگام واکنش با برخی مواد، گازهای سمی و خطرناکی مانند سولفور تریاکسید و دیاکسید گوگرد آزاد میکند. استنشاق این گازها میتواند منجر به مشکلات تنفسی، سرفه، تهوع و سرگیجه شود.
نکات ایمنی کار با سولفوریک اسید
- همیشه از تجهیزات ایمنی شامل عینکهای محافظ، ماسک تنفسی، دستکشهای ضخیم و لباسهای مخصوص در هنگام کار استفاده کنید.
- محل کار باید به تهویه مناسب مجهز باشد تا از تجمع بخارات اسید در محیط جلوگیری شود.
- بهنگام رقیقسازی، اسید سولفوریک را باید به آرامی و با احتیاط به آب اضافه کرد، نه برعکس.
- این اسید باید بصورت صحیح، در ظروف مخصوص و در مکان امن و خنک نگهداری شود.
- در صورت تماس با اسید، بلافاصله محل تماس را با آب فراوان شستشو داده و به پزشک مراجعه کنید.
علاوه بر موارد ذکر شده، خطرات دیگری نیز وجود دارد که باید توسط متخصصان و افراد فعال در این حوزه به طور کامل شناخته و در نظر گرفته شوند.
با رعایت نکات ایمنی و آگاهی از خطرات، میتوان از این ماده شیمیایی قدرتمند به طور ایمن و موثر در صنعت استفاده کرد و از بروز حوادث ناگوار جلوگیری نمود.
قیمت اسید سولفوریک
قیمت اسید سولفوریک وابسته به غلظت اسید، میزان شفافیت آن و حجم سفارشی که از طرف خریدار به فروشنده ارائه می شود به ازای هر تن بین 1.750.000 تا بسته بندی های کوچک 25.000.000 تومان است.
قیمت این اسید در بازار ایران به عوامل مختلفی بستگی دارد که می توان آنها را به صورت زیر در نظر گرفت:
- قیمت اسید سولفوریک با افزایش غلظت آن افزایش می یابد. به عنوان مثال، قیمت اسید 98% صنعتی از قیمت اسید 35% که در تصفیه فاضلاب استفاده می شود، بیشتر است.
- قیمت اسید با کیفیت و خلوص بالاتر، بیشتر است.
- نوع بسته بندی در قیمت اسید سولفوریک تاثیر دارد. این ماده شیمیایی در دو نوع تانکری و بشکه ای به فروش می رسد. قیمت فروش تانکری به دلیل حجم بیشتر، ارزان تر از نوع بشکه ای است.
- قیمت گوگرد که ماده اولیه تولید اسید سولفوریک است، در قیمت نهایی این محصول تاثیرگذار است.
- با توجه به اینکه بخش قابل توجهی از تجهیزات مورد نیاز برای تولید از خارج از کشور وارد می شود، نرخ ارز در قیمت این محصول تاثیر بسزایی دارد.
- وجود رقابت بین تولیدکنندگان می تواند تا حدی قیمت ها را تعدیل کند.
- شرایط اقتصادی کشور و تورم نیز می تواند در قیمت نهایی تاثیر داشته باشد.
در انتها پیشنهاد می شود صفحه مخزن اسید سولفوریک را نیز بازدید نمائید.







سمیعی –
کیفیت اسید سولفوریکی که از گازهای خروجی از کارخانه های مس تولید میشود با اسید سولفوریک تولیدی در کارخانه های استحضال اسید سولفوریک از گوگرد چه تفاوتی با هم دارند؟
naab zist –
اسید سولفوریکی که از دهانه کارخانه های مس خارج می شود تفاوت های مهمی با اسید سولفوریکی که از گوگرد تولید می شود دارد.
• منبع تولید: در کارخانه های مس، گوگرد موجود در سنگ معدن در فرآیند ذوب به گاز دی اکسید گوگرد تبدیل شده و سپس به اسید سولفوریک تبدیل می شود. اما در روش صنعتی، گوگرد خالص سوزانده شده و طی فرآیندی کنترل شده به اسید سولفوریک با خلوص بالا تبدیل می شود.
• خلوص و ترکیبات: اسید کارخانه های مس معمولاً ناخالصی هایی مانند فلزات سنگین و ترکیبات دیگر دارد، در حالی که اسید تولیدشده از گوگرد خالص تر و پایدارتر است.
• کاربردها: اسید سولفوریک صنعتی در تولید کودهای شیمیایی، صنایع نفت، باتری سازی و مواد شیمیایی استفاده می شود. اما اسید کارخانه های مس اغلب به عنوان محصول جانبی باقی می ماند و ممکن است نیاز به تصفیه داشته باشد.
• اثرات زیست محیطی: اسید سولفوریک کارخانه های مس به دلیل وجود آلاینده ها، در صورت مدیریت نادرست، می تواند به باران اسیدی و آلودگی محیط زیست منجر شود، در حالی که اسید صنعتی کنترل شده تر و کم خطرتر است.
در مجموع، تفاوت اصلی در خلوص، کاربرد و میزان آلودگی آن هاست؛ اسید حاصل از گوگرد خالص تر و پرکاربردتر، اما اسید کارخانه های مس ناخالص تر و معمولاً آلوده تر است.